一次电池(干电池)
放电后不可再充电(氧化还原反应不能逆向进行)
常见一次电池:锌锰干电池
- 普通锌锰干电池
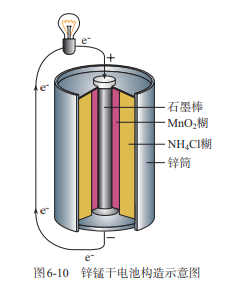
- 负极:Zn
- 正极:碳
- 电解质:NH4Cl
- 碱性锌锰干电池
- 负极:Zn
- 正极:MnO2
- 电解质:KOH
电极方程式
| 类型 | 普通锌锰干电池 | 碱性锌锰干电池 |
|---|---|---|
| 正极 | ||
| 负极 | ||
| 总式 |
二次电池
氧化还原反应可逆向进行,从而放电后充电可再次利用
能量转化:
常见二次电池 —— 铅酸蓄电池
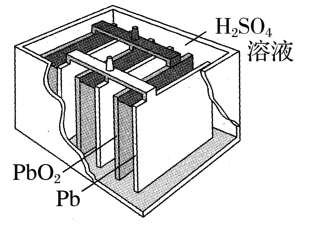
总反应:
放电:负极反应
正极:
常见二次电池——锂离子电池
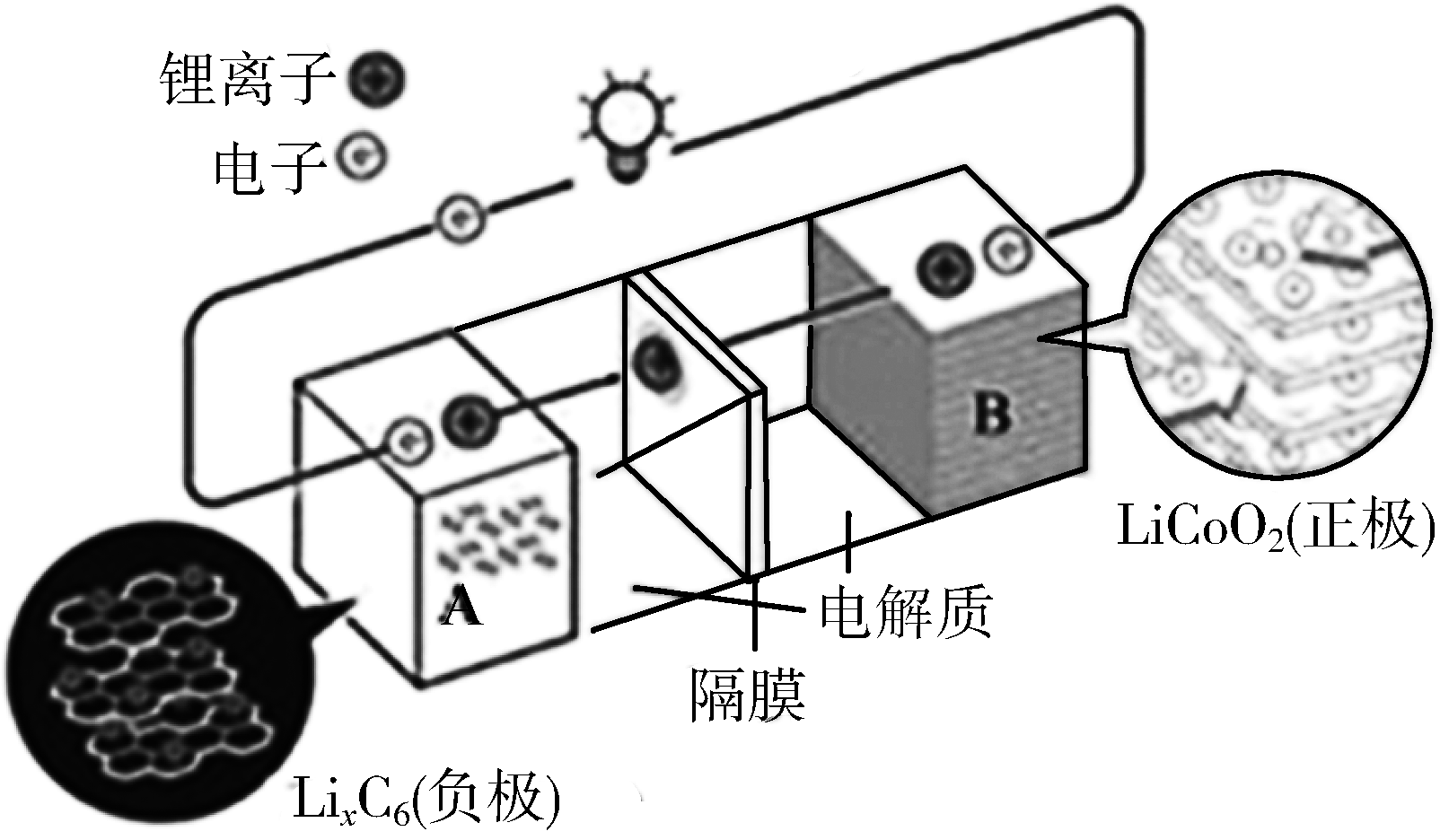
总反应:
负极:
正极:
磷酸亚铁锂高考汇编
空气电池(燃料电池)
- 燃料电池常用的燃料有: 氢气,甲烷,乙醇等,常用氧化剂:O2
- 电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等
特点:
①反应物储存在电池外部,随时得到补充
②能量转换效率高、清洁、安全,
③供电量易于调节。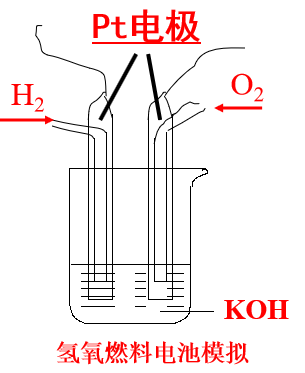
常见燃料电池
- 氢氧燃料电池
| 电解质性质 | 酸性(H2SO4) | 碱性(KOH) |
|---|---|---|
| 负电极反应 | ||
| 正电极反应 | ||
| 总式 | 同左 |
- 燃料电池总反应相当于燃料的燃烧,若产物与电解质溶液反应,则应写于总反应中
- 正极反应的本质是氧气的得电子还原,产生的氧离子存在形式与溶液的酸碱性(酸H2O,碱OH-)和电解质有关
- 碱性溶液反应式中不能出现氢离子,酸性不出现氢氧根
规律总结:
- 酸性:正极消耗H+,负极生成H+;碱性:正生OH-,负耗OH-
- 燃料电池正极通式:(使用时要注意得失电子守恒,调整系数)
- C失电子在酸性成CO2,碱性成碳酸根
- 两电极式相加=总式
甲烷燃料电池:
| 电解质性质 | 酸性(H2SO4) | 碱性(KOH) |
|---|---|---|
| 负电极反应 | ||
| 正电极反应 | ||
| 总式 |

3 条评论
这是高中化学?
是的
其实本文上周写好了,只不过手滑退出浏览器了.....